[Quipu Issue Paper] Variation study Ⅳ - Targeted Sequencing (Sequence Capture)
- Posted at 2010/02/19 10:13
- Filed under 생물정보
연재 순서
1. Assembly
2. Variation study
3. Expression study
4. Epigenomics
5. Genome Annotation
6. Next Generation Bioinformatics
7. Data Management for web 2.0 Era
8. Semantic Network for Integrated Biology Data
9. Gene Network Discovery by Text-mining
10. Centralization for High-throughput Data Analysis
이번 연재에서는 Next Generation Sequencing의 첫 번째 Application인 Variation study 중에 Targeted Sequencing (Sequence Capture) 기술에 대해 알아보도록 하겠습니다.
최근 염기서열 분석은 전체 유전체의 염기서열 분석에만 치중하지 않고, 관심이 있는 특정 유전체의 일부분을 분석하고자 하는 경향이 대두되고 있다. 또한 NGS가 출현하면서 염기서열 분석의 작업량이 증가하자 PCR을 이용한 타겟 시퀀싱에서 병목현상을 일으키기 시작하였다. 이러한 문제를 해결하기 위해 ‘Sequence Capture’라는 기술이 개발되었고 Roche NimbleGen에서 처음 상용화 되어 관심 있는 특정 유전체의 일부분을 선택적으로 분석을 할 수 있어 NGS를 이용한 유전체 분석에서 중요한 부분을 차지하게 이르렀다.
Sequence Capture 기술은 타겟으로 하는 유전체의 각 부위와 상보적으로 결합하도록 디자인된 프로브가 올려져있는 DNA chip과 분석하고자 하는 샘플의 유전체 서열간의 hybridization을 진행하여 특이적으로 결합한 DNA 절편들을 분리 후 NGS를 이용하여 직접적으로 시퀀싱을 진행하는 방식이다(그림 5).
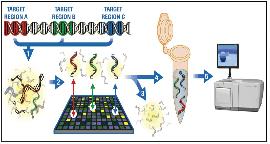 그림 5. Sequence Capture 원리.
그림 5. Sequence Capture 원리.
NGS로 염기서열을 분석하기 때문에 타겟 서열의 coverage가 굉장히 많이 향상되어 원하는 부분의 정확한 서열 정보를 얻을 수 있다. 이러한 Sequence Capture 방법을 이용하여 워싱턴주립대학과 Agilent사의 연구팀이 공동으로 Target Capture Array로부터 Illumina GA를 사용하여 8명의 HapMap Individual과 4명의 희귀질환인 Freeman-Sheldon syndrome (FSS)을 가진 환자의 엑손 영역만을 시퀀싱하여 protein coding variation을 찾은 연구를 수행하였다[8].
그 결과 Freeman-Sheldon syndrome(FSS)의 원인 유전자로 알려진 MYHS 유전자만이 정상인과 환자 사이에서 차이를 보인다는 것을 확인하였다[7]. Human의 전체 유전체는 30억 염기쌍이지만 그 중 유전자 영역인 엑손은 전체 염기의 약 1%에 해당하는 3천만 염기쌍 정도 이다. NGS 기술로 인해 유전체 시퀀싱이 쉽고 빠르게 되었다고는 하지만, 아직 높은 비용이기 때문에 이러한 엑손 시퀀싱으로 유전체 전체를 대상으로 보고자 하는 영역만을 보다 빠르고 저렴하게 분석할 수 있다는 것이 매우 고무적이라 하겠다.
다음 연재에서는 variation의 마지막 다양하게 구축되어 운영되고 있는 SNP 및 variation 데이터베이스에 대해 알아보도록 하겠습니다.
많은 관심 부탁드립니다.
참고문헌
1. 이종극 (2006) 질병유전체분석법(Genetic Variation and Diseases)
2. Eck SH, Benet-Pagès A, Flisikowski K, Meitinger T, Fries R, Strom TM. (2009) Whole genome sequencing of a single Bos taurus animal for single nucleotide polymorphism discovery. Genome Biol. 10(8), R82.
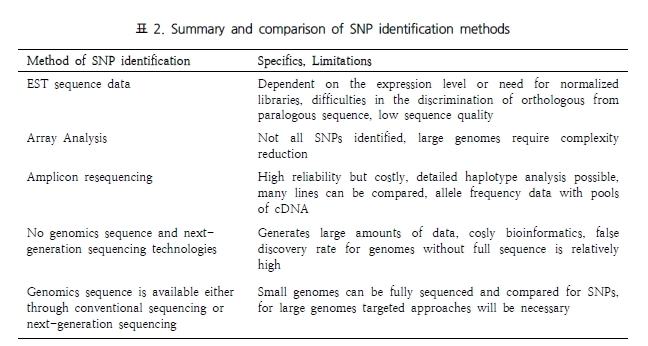
3. Ganal MW, Altmann T, Röder MS. (2009) SNP identification in crop plants. Curr Opin Plant Biol. 2, 211-217
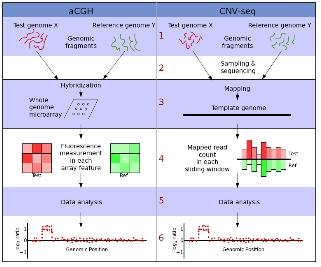
4. Xie C, Tammi MT. (2009) CNV-seq, a new method to detect copy number variation using high-throughput sequencing. BMC Bioinformatics. 10, 80
5. Illumina : SNP Genotyping and CNV Analysis
(http://www.illumina.com/documents/products/datasheets/datasheet_genomic_sequence.pdf)
6. Bentley DR. et al. (2008) Accurate whole human genome sequencing using reversible terminator chemistry. Nature. 2008 456, 53-59
7. Ng SB. et al. (2009) Targeted capture and massively parallel sequencing of 12 human exomes. Nature. 461, 272-276
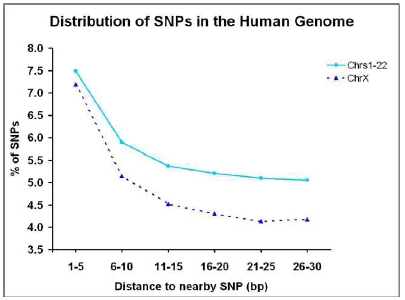
8. Koboldt DC, Miller RD, Kwok PY. (2006) Distribution of human SNPs and its effect on high-throughput genotyping. Hum Mutat. 3, 249-254.
9. 박종화 (2009) 변이체학을 위한 생정보학 분석도구. Medical POSTGRADUATES. 3(37), 131-133
10. 유향숙, 김선영 (2009) Variome 국제연구동향. Medical POSTGRADUATES. 3(37), 134-137
11. 임선희, 정연준. (2009) 새로운 유전체 변이의 등장 : 유전자 복제수 변이. Medical POSTGRADUATES. 3(37), 149-153
1. Assembly
2. Variation study
3. Expression study
4. Epigenomics
5. Genome Annotation
6. Next Generation Bioinformatics
7. Data Management for web 2.0 Era
8. Semantic Network for Integrated Biology Data
9. Gene Network Discovery by Text-mining
10. Centralization for High-throughput Data Analysis
이번 연재에서는 Next Generation Sequencing의 첫 번째 Application인 Variation study 중에 Targeted Sequencing (Sequence Capture) 기술에 대해 알아보도록 하겠습니다.
2-1-3. Targeted Sequencing (Sequence Capture)
최근 염기서열 분석은 전체 유전체의 염기서열 분석에만 치중하지 않고, 관심이 있는 특정 유전체의 일부분을 분석하고자 하는 경향이 대두되고 있다. 또한 NGS가 출현하면서 염기서열 분석의 작업량이 증가하자 PCR을 이용한 타겟 시퀀싱에서 병목현상을 일으키기 시작하였다. 이러한 문제를 해결하기 위해 ‘Sequence Capture’라는 기술이 개발되었고 Roche NimbleGen에서 처음 상용화 되어 관심 있는 특정 유전체의 일부분을 선택적으로 분석을 할 수 있어 NGS를 이용한 유전체 분석에서 중요한 부분을 차지하게 이르렀다.
Sequence Capture 기술은 타겟으로 하는 유전체의 각 부위와 상보적으로 결합하도록 디자인된 프로브가 올려져있는 DNA chip과 분석하고자 하는 샘플의 유전체 서열간의 hybridization을 진행하여 특이적으로 결합한 DNA 절편들을 분리 후 NGS를 이용하여 직접적으로 시퀀싱을 진행하는 방식이다(그림 5).

Genome 서열을 무작위 적으로 절단하여 엑손 영역만이 프로브로 심겨진 DNA chip에 hybridization한다. 이 후
DNA chip의 프로브 서열과 결합된 유전체의 엑손 서열을 chip에서 분리하여 NGS 방식의 시퀀싱으로 서열을 결정한다.
NGS로 염기서열을 분석하기 때문에 타겟 서열의 coverage가 굉장히 많이 향상되어 원하는 부분의 정확한 서열 정보를 얻을 수 있다. 이러한 Sequence Capture 방법을 이용하여 워싱턴주립대학과 Agilent사의 연구팀이 공동으로 Target Capture Array로부터 Illumina GA를 사용하여 8명의 HapMap Individual과 4명의 희귀질환인 Freeman-Sheldon syndrome (FSS)을 가진 환자의 엑손 영역만을 시퀀싱하여 protein coding variation을 찾은 연구를 수행하였다[8].
그 결과 Freeman-Sheldon syndrome(FSS)의 원인 유전자로 알려진 MYHS 유전자만이 정상인과 환자 사이에서 차이를 보인다는 것을 확인하였다[7]. Human의 전체 유전체는 30억 염기쌍이지만 그 중 유전자 영역인 엑손은 전체 염기의 약 1%에 해당하는 3천만 염기쌍 정도 이다. NGS 기술로 인해 유전체 시퀀싱이 쉽고 빠르게 되었다고는 하지만, 아직 높은 비용이기 때문에 이러한 엑손 시퀀싱으로 유전체 전체를 대상으로 보고자 하는 영역만을 보다 빠르고 저렴하게 분석할 수 있다는 것이 매우 고무적이라 하겠다.
다음 연재에서는 variation의 마지막 다양하게 구축되어 운영되고 있는 SNP 및 variation 데이터베이스에 대해 알아보도록 하겠습니다.
많은 관심 부탁드립니다.
참고문헌
1. 이종극 (2006) 질병유전체분석법(Genetic Variation and Diseases)
2. Eck SH, Benet-Pagès A, Flisikowski K, Meitinger T, Fries R, Strom TM. (2009) Whole genome sequencing of a single Bos taurus animal for single nucleotide polymorphism discovery. Genome Biol. 10(8), R82.
3. Ganal MW, Altmann T, Röder MS. (2009) SNP identification in crop plants. Curr Opin Plant Biol. 2, 211-217
4. Xie C, Tammi MT. (2009) CNV-seq, a new method to detect copy number variation using high-throughput sequencing. BMC Bioinformatics. 10, 80
5. Illumina : SNP Genotyping and CNV Analysis
(http://www.illumina.com/documents/products/datasheets/datasheet_genomic_sequence.pdf)
6. Bentley DR. et al. (2008) Accurate whole human genome sequencing using reversible terminator chemistry. Nature. 2008 456, 53-59
7. Ng SB. et al. (2009) Targeted capture and massively parallel sequencing of 12 human exomes. Nature. 461, 272-276
8. Koboldt DC, Miller RD, Kwok PY. (2006) Distribution of human SNPs and its effect on high-throughput genotyping. Hum Mutat. 3, 249-254.
9. 박종화 (2009) 변이체학을 위한 생정보학 분석도구. Medical POSTGRADUATES. 3(37), 131-133
10. 유향숙, 김선영 (2009) Variome 국제연구동향. Medical POSTGRADUATES. 3(37), 134-137
11. 임선희, 정연준. (2009) 새로운 유전체 변이의 등장 : 유전자 복제수 변이. Medical POSTGRADUATES. 3(37), 149-153
Posted by 人Co
- Tag
- capture, Illumina GA, NGS, Sequence, SNP, variation, 생물정보 분석, 엑손, 염기서열
- Response
- No Trackback , No Comment
- RSS :
- https://post-blog.insilicogen.com/blog/rss/response/43