[Quipu Issue Paper] Genome Annotation Ⅳ- 유전체 모델 결합(Gene model merging)
- Posted at 2010/03/19 10:24
- Filed under 생물정보
연재 순서
1. Assembly
2. Variation study
3. Expression study
4. Epigenomics
5. Genome Annotation
6. Next Generation Bioinformatics
7. Data Management for web 2.0 Era
8. Semantic Network for Integrated Biology Data
9. Gene Network Discovery by Text-mining
10. Centralization for High-throughput Data Analysis
이번 연재에서는 유전자 예측 프로그램과 단백질 서열을 유전체에 매핑하여 얻어진 Gene Model을 결합하는 유전체 모델의 결합(Gene model merging)에 대해 알아보겠습니다.
B-3. 유전체 모델의 결합(Gene model merging)
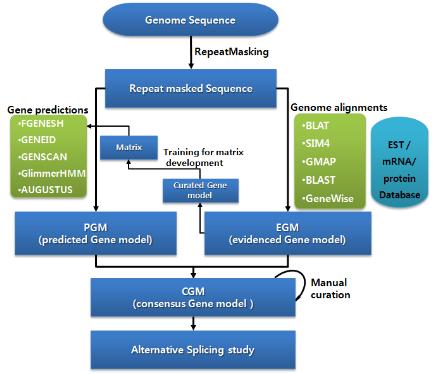
앞서 설명한 유전자 예측 프로그램을 통해서 얻어진 Predicted Gene Model(PGM)과 mRNA, EST, 단백질 서열을 유전체에 매핑하여 얻어진 Evidenced Gene Model(EGM)을 합쳐 Consensus Gene Model(CGM)을 만든다. 각 유전자 모델마다 가중치를 다르게 설정하여 동일한 위치에서 중복적으로 지지를 받아 높은 score 합계를 갖는 유전자 모델이 CGM으로 채택이 된다[3].
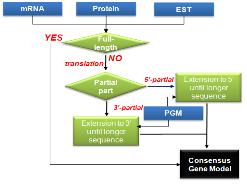
일반적으로 EGM이 PGM 보다 높은 가중치를 가지며 EGM 가운데에서도 full-length mRNA > protein> mRNA > EST 순으로 우선 순위를 배정한다. PGM도 evaluation을 통해 프로그램별 우선순위를 정해주기도 한다. CGM을 만드는 과정은 full-length mRNA를 가장 우선 순위로 채택하되, full-length mRNA가 없을 경우 단백질과 EST, PGM이 제공하는 정보를 통해 complete CGM을 형성한다(그림 5).
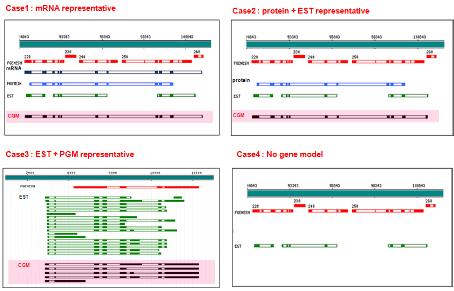
몇 가지 예시를 통해 대표 되는 유전자 모델 형성 과정을 알아보도록 하자.
첫 번째 full-length mRNA를 통해 얻어진 EGM이 partial 단백질과 ESTs에 의해 공통적으로 exon/intron 정보를 제공 받아 complete CGM을 형성하였다(그림 6의 case1). 다음은 mRNA EGM이 없고 단백질 EGM이 가장 높은 가중치를 갖는 유전자 모델이 되어 EST 가 제공하는 3’ 정보를 통해 complete CGM을 형성한 경우 이다. 이때 EST EGM은 단백질 EGM의 partial 형태로 동일한 exon/intron 구조를 보이고 있다. 세 번째는 mRNA, 단백질 모두 존재하지 않고 partial ESTs EGM 만 존재할 때 EST EGM 하나 하나는 모두 낮은 가중치이나 동일한 위치에서 동일한 exon/intron 구조로 여러 ESTs EGM이 지지하고 있으므로 CGM을 형성할 수 있다. 또한 일정부분 동일한 유전자 구조를 갖는 PGM으로부터 3’ 정보를 제공 받아 complete CGM을 형성하였다. 마지막 네 번째 경우 세 번째 경우와 동일하게 PGM과 EST EGM이 존재하는 가운데 두 gene model이 서로 상이한 exon/intron구조를 보이고 있어 어떠한 CGM도 만들 수 없는 상황을 보여주고 있다. 만약 PGM 만이 존재할 경우라도 여러 프로그램을 통해 얻어진 PGM이 모두 동일한 exon/intron 구조를 갖는다면 CGM을 형성 할 수 있다. 대부분의 genome annotation에서 evidence 데이터를 충분히 갖추고 진행되기란 쉽지 않다. 따라서 종종 Evidenced Gene Model(EGM) 없이 Predicted Gene Model(PGM) 만으로 Consensus Gene Model(CGM)을 만드는 경우가 존재한다.
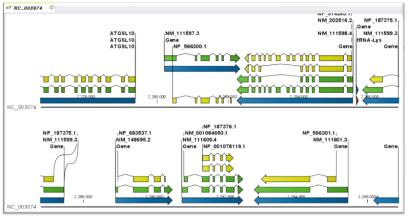
C. Alternative splicing analysis
다양한 유전자 모델을 통해 Consensus Gene Model을 형성하고 나면 이후 alternative splicing 분석을 위해 transcripts를 분석한다[12]. mRNA, ESTs, 단백질, NGS reads 서열이 제공하는 다양한 transcripts를 consensus gene model (CGM)에 비교하여 alternative transcript model을 제시 한다. 이후 조직 특이적인 alternative transcripts나 cancer specific alternative transcripts 분석으로 biological meaning에 초점을 두고 분석을 진행하게 된다[3].
그림 7. Alternative splicing 분석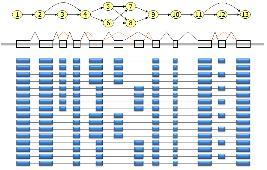
다음 연재에서는 유전자의 기능을 분석하는 방법 중에 먼저 상동성 기반의 Annotation에 대해 알아보겠습니다. 많은 관심 부탁드립니다.
참고문헌
1. Lowe, T.M. and Eddy, S.R. (1997) tRNAscan-SE: a program for improved detection of transfer RNA genes in genomic sequence. Nucleic Acids Res. 25, 955-964.
2. Lewis SE, et al. (2002). Apollo: a sequence annotation editor. Genome Biology. 12, research0082
3. Noh SJ, Lee K, Paik H, Hur CG. (2006) TISA: tissue-specific alternative splicing in human and mouse genes. DNA Res. 13, 229-243
4. Stanke M, Schoffmann O, Morgenstern B, Waack S. (2006) Gene prediction in eukaryotes with a generalized hidden Markov model that uses hints from external
sources. BMC Bioinformatics. 7, 62.
5. Burge, C. and Karlin, S. (1997) Prediction of complete gene structures in human genomic DNA. J. Mol. Biol. 268, 78-94.
6. Salamov AA, Solovyev VV. (2000) Ab initio gene finding in Drosophila genomic DNA. Genome Res. 10, 516–522.
7. Majoros, W.H., Pertea, M., and Salzberg, S.L. TigrScan and GlimmerHMM: two open-source ab initio eukaryotic gene-finders Bioinformatics 20, 2878-2879.
8. G. Parra, E. Blanco, and R. Guigó, (2000) Geneid in Drosophila Genome Research 4, 511-515.
9. Haas BJ, Salzberg SL, Zhu W, Pertea M, Allen JE, Orvis J, White O, Buell CR, Wortman JR. (2008) Automated eukaryotic gene structure annotation using
EVidenceModeler and the Program to Assemble Spliced Alignments. Genome Biology 9, R7
10. Korf I. (2004) Gene finding in novel genomes. BMC Bioinformatics. 5, 59.
11. Kan, Z., Rouchka, E.C., Gish, W., and States, D. 2001, Gene structure prediction and AS analysis using genomically aligned ESTs, Genome Res. 11, 889–900.
12. Eyras, E., Caccamo, M., Curwen, V., and Clamp, M. 2004, ESTGenes: AS from ESTs in Ensembl, Genome Res. 14, 976–987.
13. Kent, W.J. 2002, BLAT-The BLAST-Like Alignment Tool, Genome Res. 12, 565–664.
14. Florea, L., Hartzell, G., Zhang, Z., Rubin, G.M., Miller, W. 1998, Computer program for aligning a cDNA sequence with a genomic DNA sequence, Genome Res. 8,
967–974.
15. Huang X, Adams MD, Zhou H, Kerlavage AR. (1997) A tool for analyzing and annotating genomic sequences. Genomics. 46, 37–45.
16. Wu TD, Watanabe CK. (2005) GMAP: a genomic mapping and alignment program for mRNA and EST sequences. Bioinformatics. 21, 1859–1875.
17. Birney E, Clamp M, Durbin R. (2004) GeneWise and Genomewise. Genome Res. 14, 988–995.
Posted by 人Co
- Tag
- Alternative splicing, Consensus Gene Model, EST, Evidenced Gene Model, EVModeler, Gene model merging, GFF3, insilicogen, mRNA, NGS, Predicted Gene Model, Tigr, 유전자 예측, 인실리코젠
- Response
- No Trackback , No Comment
- RSS :
- https://post-blog.insilicogen.com/blog/rss/response/60